알기 쉬운 의료기기
닫기
한눈에 보는 의료기기 안전관리
- 홈으로 이동
- 알기 쉬운 의료기기
- 한눈에 보는 의료기기 안전관리
의료기기 전주기 안전관리 체계도
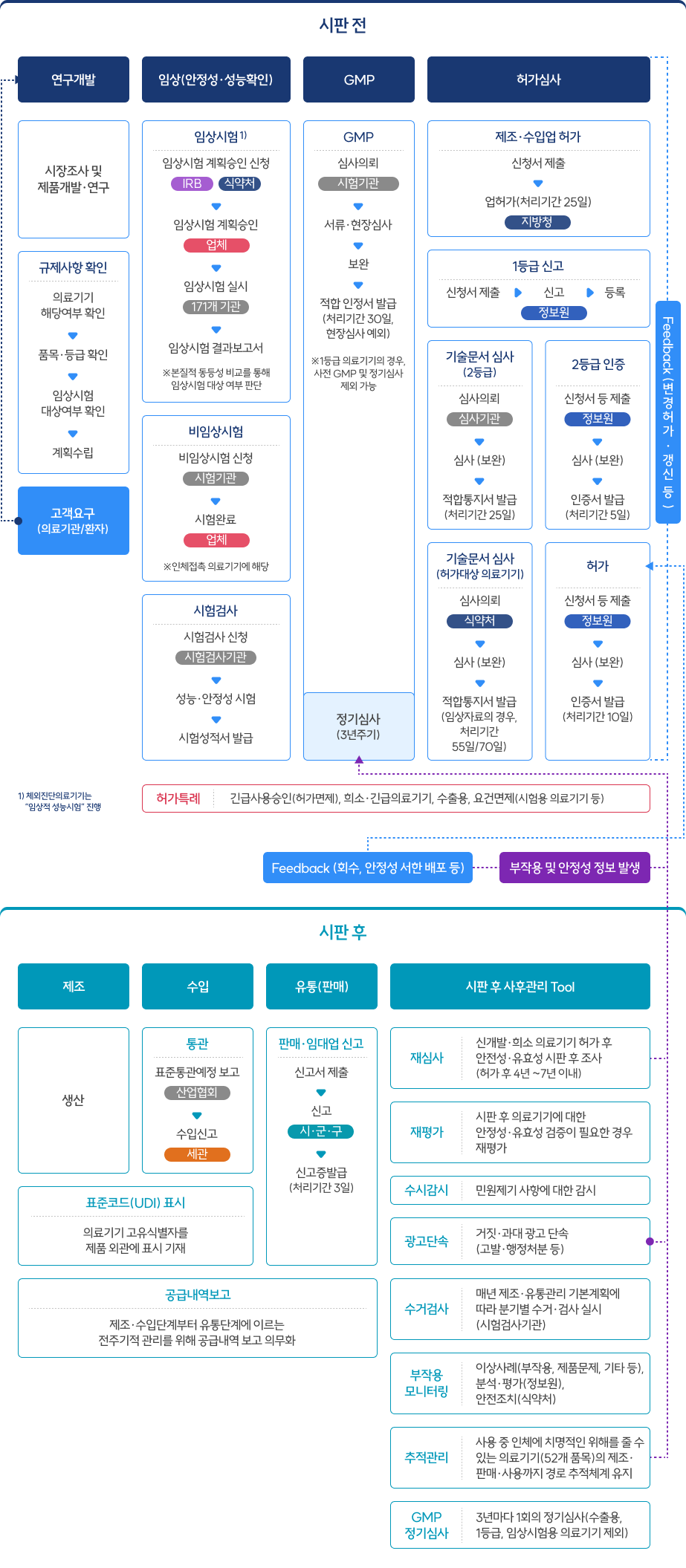
의료기기 산업육성 지원 혁신의료기기지정, 의료기기허가 도우미, 체외진단의료기기 표준품 지원 등
[28159] 충청북도 청주시 흥덕구 오송읍 오송생명2로 187 오송보건의료행정타운 식품의약품안전처
[08389] 서울특별시 구로구 디지털로 30길 28, 마리오타워 102, 208, 303-1, 305호 한국의료기기안전정보원(운영)
Copyright © By Ministry of Food and Drug Safety. All rights reserved.






















